Les bases de l'électricité

Bienvenue sur notre page dédiée aux bases de l'électricité. Que vous soyez un débutant curieux ou un expert cherchant à rafraîchir ses connaissances, ce guide est conçu pour vous. Notre objectif est de vous fournir les outils essentiels pour comprendre l'électricité et aborder le dépannage électronique avec confiance, tout en insistant sur la sécurité.
⚡ Définition de l’électricité
L’électricité est une forme d’énergie résultant du déplacement des électrons au sein de la matière. Ce mouvement se produit lorsqu’une différence de potentiel électrique (tension) est appliquée, forçant les électrons à circuler à travers un matériau conducteur. L’électricité permet ainsi d’alimenter des appareils, de transmettre de l’énergie et de faire fonctionner les circuits électroniques.
👉 L’électricité, c’est le déplacement des électrons dans un circuit.
⚡ L’origine de l’électricité
L’origine de l’électricité se trouve au cœur de la matière, dans la structure de l’atome. Tous les atomes contiennent des électrons, des particules chargées négativement, qui gravitent autour du noyau. Lorsque ces électrons se déplacent de manière organisée, ils produisent ce que l’on appelle l’électricité.
⚛️ Qu’est-ce qu’un atome ?
Un atome est la plus petite unité de matière qui conserve les propriétés d’un élément chimique (cuivre, silicium, aluminium, etc.). Toute la matière qui nous entoure composants électroniques, fils électriques, écrans, batteries est constituée d’atomes. Celui-ci est formé d'un noyau central contenant des protons et des neutrons.
👉 Un atome est une brique microscopique qui compose toute la matière.
⚛️ Structure générale de l’atome
Un atome est constitué d’un noyau central, formé de protons et de neutrons, autour duquel gravitent des électrons. Ce sont ces électrons, et en particulier ceux situés sur les couches externes, qui jouent un rôle clé dans la circulation du courant électrique, les liaisons entre matériaux et le comportement des conducteurs, isolants et semi-conducteurs. Un atome possède deux parties comme le montre la figure E4.
- Les protons : Sont situés dans le noyau, ils ont une charge positive.
- Les électrons : Ils orbitent autour du noyau et ont une charge négative.
- L'électricité se manifeste lorsque ces électrons se déplacent d'un atome à un autre proton

Figure E4 Représentation de la structure d’un atome noyau + électrons.
⚛️ Composition d’un atome
L’atome est la brique fondamentale de toute la matière. Comprendre sa composition est essentiel pour saisir le fonctionnement de l’électricité et de l’électronique. Un atome est constitué de trois particules fondamentales réparties en deux zones vous avez le noyau et le nuage électronique. La figure E5 représente la composition d'un atome.
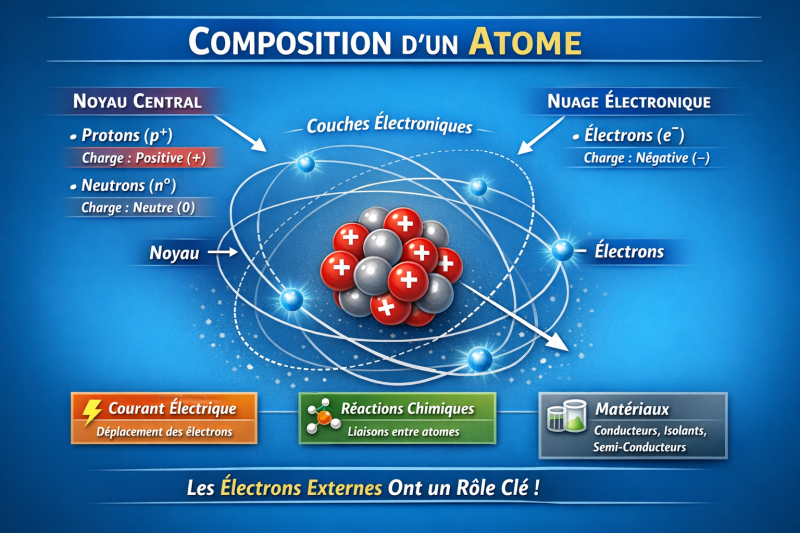
Figure E5 La composition d’un atome.
🔴 1. Le noyau
Situé au centre de l’atome, il contient :
Protons (p⁺)
Charge : positive (+)
Rôle : détermine l’élément chimique
Neutrons (n⁰)
Charge : neutre (0)
Rôle : assure la stabilité du noyau
👉 Le noyau représente presque toute la masse de l’atome.
🔵 2. Les électrons
Charge : négative (−)
Ils gravitent autour du noyau sur des couches électroniques
Ils sont responsables :
du courant électrique
des liaisons chimiques
du comportement des matériaux
⚖️ Neutralité de l’atome
Un atome est électriquement neutre lorsque :
Nombre de protons = nombre d’électrons
🔵Les électrons autour du noyau
Dans un atome, les électrons sont des particules chargées négativement qui gravitent autour du noyau, lequel contient les protons et les neutrons. Ils ne se déplacent pas au hasard ils occupent des zones d’énergie appelées couches électroniques. La figure E6 montre les électrons autour du noyaux.

Figure E6 Les électrons autour du noyau.
⚛️ Les couches électroniques
Les électrons sont répartis sur plusieurs couches autour du noyau :
-
Couche K : la plus proche du noyau (max. 2 électrons)
-
Couche L : deuxième couche (max. 8 électrons)
-
Couche M : troisième couche (max. 18 électrons)
👉 Plus une couche est éloignée du noyau, plus ses électrons sont faiblement liés.
⚛️ Organisation des couches
Chaque couche peut contenir un nombre limité d’électrons :
| Couche | Nom | Capacité maximale |
|---|---|---|
| 1 | K | 2 |
| 2 | L | 8 |
| 3 | M | 18 |
| 4 | N | 32 |
Les électrons remplissent d’abord les couches proches du noyau avant les couches extérieures.
⚡ Les électrons de valence
Les électrons situés sur la dernière couche sont appelés électrons de valence.Ils sont essentiels car :
-
ils peuvent se déplacer plus facilement
-
ils participent aux réactions chimiques
-
ils permettent la circulation du courant électrique
🔌 Lien avec l’électricité
-
Dans les conducteurs (cuivre, aluminium), certains électrons de valence sont libres → le courant circule facilement
-
Dans les isolants, les électrons sont fortement liés → pas de courant
-
Dans les semi-conducteurs (silicium), les électrons peuvent être libérés sous certaines conditions (tension, chaleur, lumière)
🧠 À retenir
-
Les électrons gravitent autour du noyau sur des couches bien définies
-
Les électrons externes déterminent le comportement électrique des matériaux
-
Le déplacement des électrons est à l’origine du courant électrique